- 主题
- 217
- 您的身份
- 病友
- 病理报告
- 滤泡性淋巴瘤1-2级
- 目前状态
- 治疗中
参加活动:0 次 组织活动:0 次
您的身份病友
病理报告滤泡性淋巴瘤1-2级
目前状态治疗中
最后登录2026-2-14
|
近期,阿斯利康在clinical trials网站上,登记其CD19/CD3双特异性抗体AZD0486,联合CD20抗体rituximab,在一线滤泡性淋巴瘤患者中,启动一项三期临床试验NCT06549595。该临床预计将于2024年8月启动,计划入组人数为1005例。
该临床预计将分为两个部分,第一部分将使用不同剂量考察和rituximab的安全性,以确定最终3期剂量。第二部分将分为三个队列考察相对于标准治疗R-CVP+rituximab维持治疗,或R-CHOP+rituximab维持治疗的优效性,有望开启一线滤泡性淋巴瘤的去化疗时代。
AZD0486是一种新型全人源CD19/CD3双特异性抗体,2022年阿斯利康以12.65亿美元收购TeneoTwo公司时获得,前身为TNB-486。
Teneobio以开发创新性的CD3抗体著称,其从转基因鼠免疫后得到的139株CD19抗体克隆中,筛选到一株特殊表位的低亲和力CD3抗体F2B,其亲和力为34 mM,只结合CD3δε表位,不结合CD3γε表位,对食蟹猴同时具有结合。
AZD0486采用非对称设计,CD3部分使用Fab结构,CD19部分为纳米抗体。独特CD3抗体设计可减少AZD0486细胞因子的释放,同时保留T细胞介导的强效细胞毒性,IgG4沉默后的Fc段可减少非特异性结合、抗体依赖性细胞毒性,同时提供了适合间歇给药的长半衰期,食蟹猴模型中显示其半衰期为11.4-12.9天。
除了良好的安全性和药效,AZD0486同时具备良好的成药性,具有可观的抗体表达量、理化稳定性和热力学稳定性。
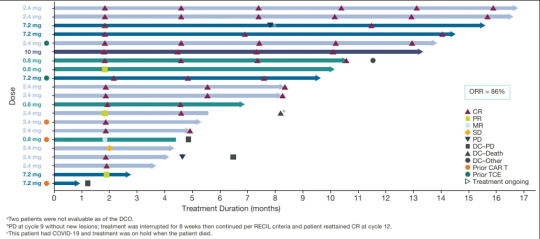
2023年12月召开的第65届美国血液学会(ASH)年会上,AZD0486更新了其一期临床研究结果。65例B细胞非霍奇金淋巴瘤患者,中位随访5.72个月,滤泡性淋巴瘤患者的总缓解率(ORR)为86%,中位缓解持续时间(DOR)未达到。
在滤泡性淋巴瘤患者的2.4 mg剂量组(n=11)中,完全缓解率为91%,对于所有接受2.4 mg或以上剂量的疗效可评估滤泡性淋巴瘤(n=17)患者,完全缓解率为83%,总缓解率达88%。
安全性方面,实施双次剂量方案后,未观察到任何≥3级细胞因子释放综合征(CRS)或免疫效应细胞相关神经毒性综合征(ICANS)。同时,对于弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤患者,相较于单次及固定剂量给药,双次剂量方案1-2级CRS和ICANS发生率大幅下降。无治疗相关死亡报告,无治疗相关不良事件导致停药。
值得注意的是,阿斯利康的AZD0486启动的三期临床试验直接采用了和CD20抗体rituximab(美罗华)联用的策略,在不同的恶性B细胞肿瘤中,CD19的表达不一,同时从机理上CD19比CD20处于B细胞的更早期表达。
阿斯利康显然也对比了目前CD20/CD3双抗在滤泡性淋巴瘤中的疗法,虽然AZD0486拥有一定的疗效优势,但是16%的病人会出现CD19和CD20抗原丢失,AZD0486和rituximab的联用显然会提高疗效,阿斯利康为AZD0486也给出50亿美金的年销售峰值预测。
|
|
 /1
/1 