- 主题
- 217
- 您的身份
- 病友
- 病理报告
- 滤泡性淋巴瘤1-2级
- 目前状态
- 治疗中
参加活动:0 次 组织活动:0 次
您的身份病友
病理报告滤泡性淋巴瘤1-2级
目前状态治疗中
最后登录2026-2-16
|
弥漫大B细胞淋巴瘤(DLBCL)经过标准一线治疗方案R-CHOP治疗后治愈率可达60%-70%,然而,约30%-40%患者仍会出现难治或复发(R/R)。R/R DLBCL患者首选大剂量挽救性化疗后序贯自体干细胞移植(ASCT),但约一半患者无法从大剂量挽救性化疗中获得缓解,从而失去移植的机会;对于不符合移植条件的患者虽然可以选择免疫化疗等系统性治疗,但治疗获益有限,不适合移植的R/R DLBCL患者中位生存期不超过1年[1]。因而,亟需探索新的治疗方式或联合治疗模式以提高R/R DLBCL患者的生存获益。
Tafasitamb(坦昔妥单抗,Tafa)是一款靶向CD19的人源化单克隆抗体,通过独有的工程化Fc结构域改造,显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),也可通过细胞凋亡和免疫效应机制介导B细胞肿瘤的裂解。基于L-MIND研究,Tafa在美国获得加速批准,在欧洲获得有条件授权,与来那度胺(Len)联合治疗用于不适合ASCT的R/R DLBCL患者。近期,Haematologica杂志更新了II期L-MIND研究的5年随访数据,【肿瘤资讯】特邀广东省人民医院李文瑜教授对该研究进行解读,以飨读者。
Haematologica:II期L-MIND研究随访5年的最终疗效和安全性结果[2]
研究设计
L-MIND研究为开放标签、单臂、全球多中心II期研究,纳入年龄≥18岁、不符合ASCT条件的R/R DLBCL患者,既往接受过1-3次全身治疗(包括CD20靶向治疗方案),ECOG PS 0-2。Tafa(12mg/kg)与来那度胺(25mg)联合使用,最多12个周期,然后序贯Tafa单药维持治疗,直到出现疾病进展(PD)或不可耐受的毒性。主要研究终点为客观缓解率(ORR)(由独立评估委员会决定)。次要研究终点包括缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)以及不良事件(AE)等。
研究结果
本研究共入组80例患者,中位年龄为72岁(范围为41-86岁)。50%的患者(2L)接受过一线治疗;50%的患者(3L+)之前接受过≥2线治疗。50%的患者IPI评分为3-5分。9例患者既往接受过干细胞移植。
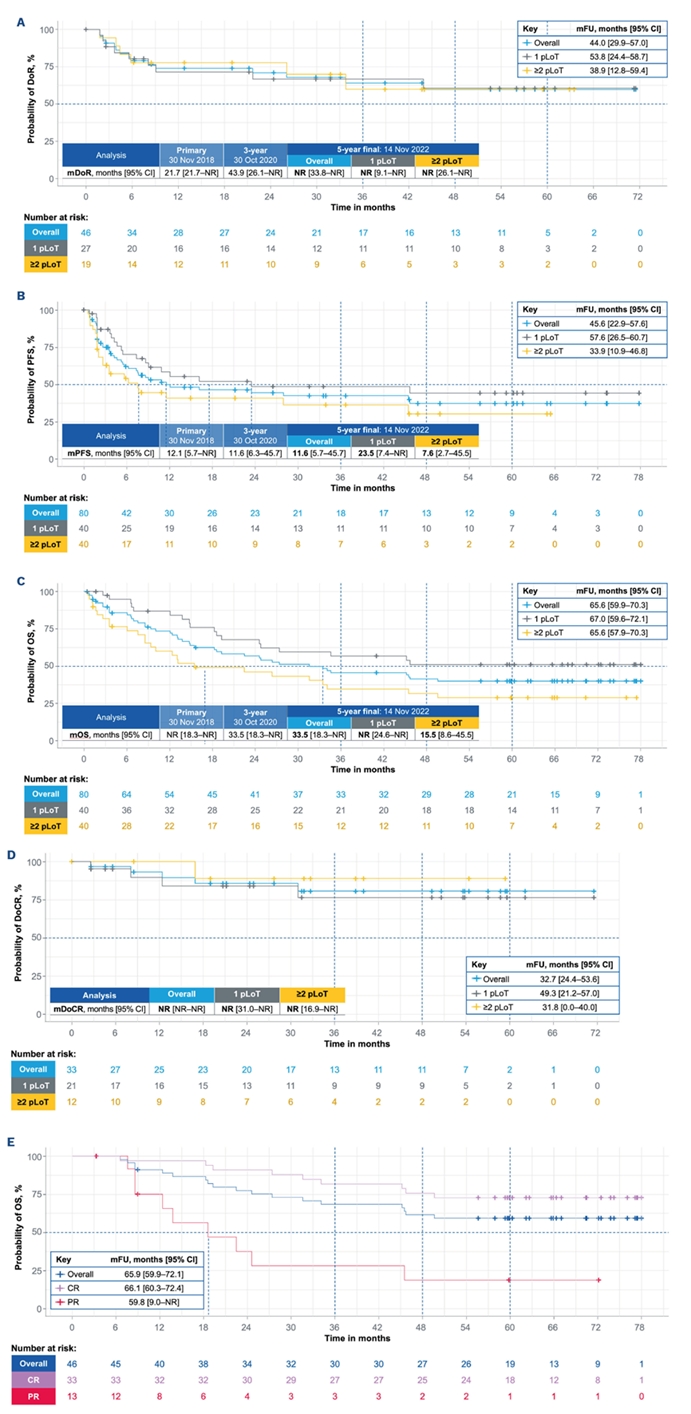
在本次5年随访数据中,独立评估委员会评估的最佳ORR为57.5%(95%CI:45.9-68.5),CR率为41.3%(33例),PR率为16.3%(13例),与之前3年分析结果一致。另外有16.3%的患者(13例)疾病稳定。生存率方面,中位(m)PFS为11.6个月 (95%CI: 5.7-45.7),mOS为33.5个月 (95% CI:18.3-NR)。中位DoR和DoCR尚未达到;5年CR持续时间(DoCR)率预估为80.7%(图1)。
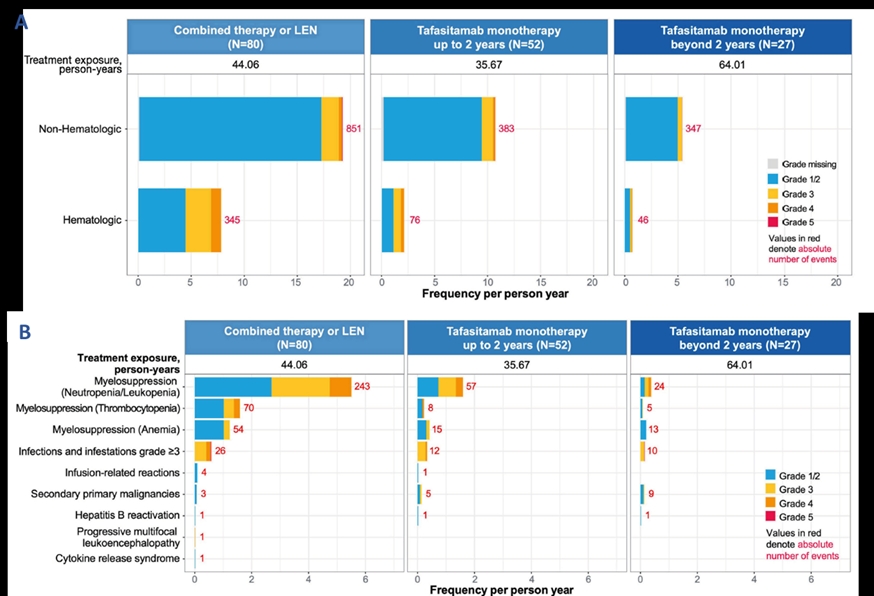
在安全性方面,与既往报道一致,最常出现的任何级别AE为中性粒细胞减少(49.4%),贫血(37%)、血小板减少症(28.4)、虚弱(25.9%)、周围性水肿(24.7%)、发热(23.5%)等,3级以上常见AE为中性粒细胞减少(48.1%)、血小板减少(16.0%)等。并且随着治疗时间的延长,AE发生率及严重程度均呈现明显下降(图2)。
L-MIND研究的5年长随访研究结果显示,Tafa+Len治疗不适合移植的R/R DLBCL的ORR 57.5%,CR率 41.3%,mPFS 11.6个月,mOS 33.5个月,为患者带来良好的长期生存获益。一项基于L-MIND研究与其他免疫化疗、CAR-T细胞治疗的1:1匹配回顾性研究(RE-MIND2)结果显示,Tafa+Len对比Pola-BR、R2方案(mOS:分别为20.1个月 vs. 7.2个月;24.6个月 vs. 7.4个月)具有显著的生存期优势;与CAR-T细胞治疗相比具有相似的生存获益(图3)[3]。相比现有治疗方案,Tafa+LEN方案具有更好的生存获益及良好安全性。
除此之外,Tafa+Len方案还具有“高缓解”与“长生存”的优势。L-MIND研究中,CR率高达37.8%,具有媲美CAR-T的CR率(43.2%),远高于现有治疗方案(图4)。并且一旦达到CR患者,其生存期远高于PR患者(图1E)。CR患者的5年DoCR率高达80.7%。研究入组患者中位年龄为72岁。因此,对于高龄患者若疗效达到CR基本可以实现“临床治愈”。
日前,CDE官网公示,诺诚健华申报的注射用坦昔妥单抗(Tafasitamab)拟纳入优先审评,拟定适应症为联合来那度胺用于治疗R/R 且不适合ASCT的DLBCL成人患者[4]。因此,我们也期待Tafa能够早日在国内正式上市,造福中国患者!
|
|
 /1
/1 