|
关于RRMM
“CAR-T 疗效虽惊艳,但复发的阴影始终笼罩着部分患者”
在血液肿瘤治疗领域,CAR-T 疗法无疑是里程碑式的突破,尤其针对复发难治性多发性骨髓瘤(RRMM),BCMA 靶向 CAR-T 已成为重要治疗手段。然而临床中发现,部分患者仍面临治疗无响应或复发的困境,尤其是合并髓外病变(EMD)的群体,CAR-T 细胞功能耗竭、肿瘤微环境抑制等问题更突出,如何优化 CAR-T 设计、提升疗效与持久性,成为临床亟待解决的难题。
下面分享一项突破性的 CAR-T 改良技术,通过精准调控细胞信号通路,为这类难治患者点亮新的治疗方向

发表期刊:J Immunother Cancer
1. 传统CAR-T治疗的局限
RRMM 患者即便接受了 BCMA 靶向 CAR-T 治疗,仍有部分人疗效不佳或短期复发,深入研究发现核心问题集中在三方面:一是肿瘤免疫微环境存在强抑制作用,PD-1/PD-L1 信号通路会持续激活,导致 CAR-T 细胞过早进入耗竭状态,失去抗肿瘤能力;二是 CAR-T 细胞在体内持久性不足,难以形成长期免疫记忆,无法应对肿瘤的后续反扑;三是合并髓外病变的患者预后更差,传统 CAR-T 在这类复杂病灶中难以有效浸润和发挥作用,治疗响应率远低于无髓外病变患者。
这些难题让临床医生和患者都迫切需要更高效、更耐用的 CAR-T 治疗方案。
2. PD-1下调BCMA CAR-T的设计亮点
为突破传统 CAR-T 的局限,研究团队针对性研发了一款融合双重优化设计的新型 CAR-T 产品,其核心创新点围绕 “增强功能 + 延长存续” 展开:首先是精准下调 PD-1 表达,通过在 CAR 结构中嵌入抗 PD-1 短发夹 RNA(shRNA),直接从细胞内部阻断 PD-1/PD-L1 抑制通路,避免 CAR-T 细胞被肿瘤微环境 “驯化” 而耗竭;其次是加入 OX-40 共刺激域,该信号分子能显著提升 CAR-T 细胞的增殖能力,同时促进中央记忆 T 细胞形成,让 CAR-T 细胞既能快速杀伤肿瘤,又能长期留存体内防范复发;最后是一体化设计提升安全性,无需额外联合 PD-1 抗体治疗,不仅简化了治疗流程,还避免了抗体与 CAR-T 细胞剂量难以匹配的问题,降低了不可预测毒性的风险。
3. 从实验室到临床的亮眼数据
临床前研究表现卓越
在体外实验中,研究团队模拟肿瘤抑制性微环境,发现 PD-1 下调 BCMA CAR-T 细胞即便在 PD-L1 过表达的条件下,仍能保持强大的细胞毒性,对骨髓瘤细胞的杀伤率显著高于传统 BCMA CAR-T,同时细胞因子分泌能力更稳定。
经过多轮重复抗原刺激后,该 CAR-T 细胞的凋亡率明显降低,中央记忆 T 细胞(CD62L+CD45RA-)比例较传统组提升近 1 倍,而 CTLA4、LAG3 等耗竭相关基因的表达水平显著下降;在动物实验中,接种 PD-L1+BCMA + 骨髓瘤细胞的小鼠,接受 PD-1 下调 BCMA CAR-T 治疗后,肿瘤生长速度明显减缓,部分小鼠实现肿瘤完全清除,生存期较传统 CAR-T 治疗组延长 40% 以上,且小鼠肝脏、肾脏等器官未出现明显损伤,安全性得到验证。
Ⅰ期临床试验成果喜人
研究团队随后开展了 Ⅰ 期临床试验,共纳入 7 名经多线治疗失败的 RRMM 患者,其中 4 名(57.1%)合并髓外病变,4 名(57.1%)存在 del (17p)、t (4;14) 等高危细胞遗传学特征,所有患者均未接受过 BCMA 靶向治疗。
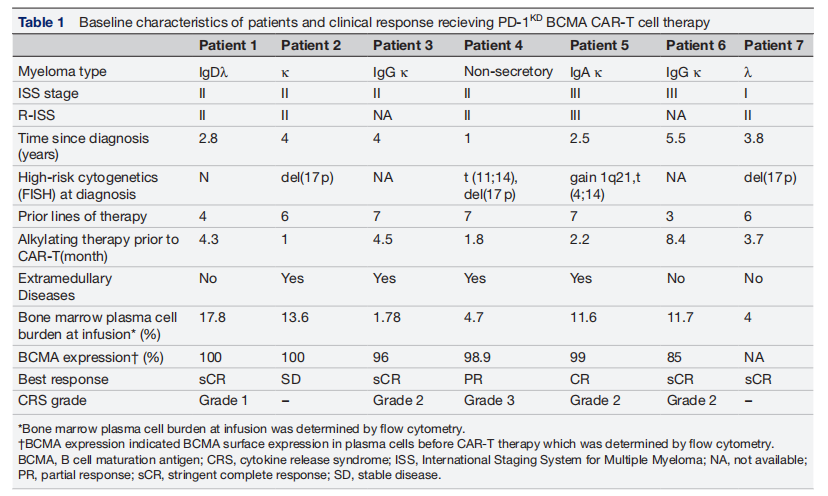
接受 PD-1 敲低(PD-1KD)BCMA CAR-T 细胞治疗患者的基线特征及临床应答
治疗前,患者先接受氟达拉滨联合环磷酰胺的预处理方案,随后分 3 次输注 PD-1 下调 BCMA CAR-T 细胞。从疗效来看,总缓解率(ORR)达 85.7%,其中 4 名患者实现严格完全缓解(sCR),1 名完全缓解(CR),1 名部分缓解(PR),仅 1 名患者维持稳定疾病(SD);特别值得关注的是合并髓外病变的患者,治疗后 PET-CT 显示,原本存在于淋巴结、肌肉、肝门区的病灶均明显缩小或消失,髓外病灶控制效果远超预期。

(A)PD-1KD BCMA CAR-T 细胞临床治疗方案及临床 / 实验室监测示意图。* 在细胞制备期间,患者可能需接受治疗以控制病情。** 首次随访(第 28 天)后,前 6 个月每 4 周随访 1 次,之后至 2 年期间每 3 个月随访 1 次。***Pre-tx(治疗前):指 CAR-T 细胞输注前 3-7 天。Flu 代表氟达拉滨(fludarabine),Cy 代表环磷酰胺(cyclophosphamide)。(B)采用环磷酰胺联合氟达拉滨进行预处理、并分三次输注 CAR-T 细胞的患者,通过实时荧光定量聚合酶链反应(qPCR)检测其外周血中 CAR-T 细胞的数量。(C- F)通过酶联免疫吸附试验(ELISA)检测所有接受 PD-1KD BCMA CAR-T 细胞输注患者血清中的细胞因子浓度。(G)游泳图(Swimmer plot):展示每位受试者随时间变化的应答类型,以及通过骨髓穿刺液流式细胞术检测微小残留病(MRD)的结果。(H)髓外病变应答情况:PD-1KD BCMA CAR-T 细胞输注后,髓外浸润病变消失或缩小。图中展示了 3 号患者和 5 号患者治疗前后的代表性正电子发射断层显像 - 计算机体层显像(PET-CT)图像,以及 4 号患者治疗前后的磁共振成像(MRI)图像。红色箭头指示髓外病变部位,浅蓝色箭头指示肿瘤缩小部位。
在安全性方面,仅 5 名患者出现细胞因子释放综合征(CRS),其中 4 名为 1-2 级,经支持治疗后缓解,1 名出现 3 级 CRS,通过托珠单抗联合地塞米松治疗后症状控制,整个试验过程中无免疫效应细胞相关神经毒性综合征(ICANS)发生,患者耐受性良好;截至末次随访,4 名患者仍保持持续缓解状态,1 名患者在 19.2 个月时出现复发,其余患者仍在持续随访中。
总结 为更多患者拓展治疗边界 这项研究通过创新设计,证实 PD-1 下调联合 OX-40 共刺激域的 BCMA CAR-T,能有效克服肿瘤抑制性微环境的影响,同时提升 CAR-T 细胞的增殖能力、记忆功能和抗耗竭能力,尤其为合并髓外病变的高危 RRMM 患者提供了更有效的治疗选择。
虽然目前研究仍存在样本量较小、缺乏对照组等局限,需要更大规模、多中心的长期随访研究来进一步验证疗效和安全性,但这一设计理念为 CAR-T 疗法的优化提供了重要方向 —— 通过细胞内在的功能改良,而非依赖外部药物联合,就能显著提升治疗效果。
未来,这一技术不仅有望在多发性骨髓瘤领域进一步推广,还可能拓展至淋巴瘤、白血病等其他血液肿瘤,甚至为实体瘤 CAR-T 治疗提供借鉴,为更多难治性肿瘤患者带来新的希望。
参考文献: Ouyang W, et al. J Immunother Cancer. 2024 Apr 8;12(4):e008429.
扫码可直接下载文献原文 END 供稿:洪飞 | 排版:蒲蝶 | 审核:关关 |  /1
/1 