|
病例故事
“求救,我老公36岁,弥漫大B,做了自体移植+单靶CAR-T,3个月进展,怎么办?”
热辣的8月,我的微信收到了一位弥漫大b家属的求助,简练的描述,显然是一位已经对这个病了如指掌的学霸型家属。我该怎么帮她呢?作为同样是患者身份的我,可以理解经历这么多治疗后的无助与迷茫。
自体移植失败,CAR-T也失败,这样的结果确实治疗难度已经很大了,我们所谓的一些新药可能也只是短暂缓解,并不能再治愈我们的病友,这么年轻的病友,当然目标是治愈啊。
这让我想起来另一位病友CAR-T后失败的经历。
2024 年 9 月,我还在英国参加国际华氏巨球蛋白血症基金会(IWMF)的年会。一位患者的女儿通过淋巴瘤之家APP找到并添加了我的微信,因时差原因,她本以为我已经休息,没想到我正精力旺盛。
她给我发来了父亲老马(60 岁)的病例:EB 病毒阳性(EBV+)弥漫大 B 细胞淋巴瘤(DLBCL)Ⅳ 期 B 组,接受奥布替尼 + R-CHOP 方案治疗后 2 个月复发,活检意外提示CD20 抗原表达缺失(CD20-) ,这意味着双抗,利妥昔单抗后续可能都不适合使用了。
联系我询问解决方案时,结合以往经验,如此短时间进展的情况下,常规二线和自体移植都希望渺茫,唯有CAR-T可以搏一下,而患者家里没有能力负担商业CAR-T,选择参加CAR-T试验组。
首试双靶点 CAR-T
第一时间为老马联系好医生并住院后,自 2024 年 9 月起,采用Pola+Gemox方案作为CAR-T治疗前的桥接方案,FC方案进行清淋后回输CD19-CAR-T及CD22-CAR-T治疗。
双靶点CAR-T疗法被寄予厚望,然而事与愿违。回输细胞后,患者CT复查显示部分缓解,但CAR-T细胞扩增效果并不理想,且患者很快出现发热症状。11月评估时,疾病进展为PD;这样的结果对每个家庭而言都难以接受。
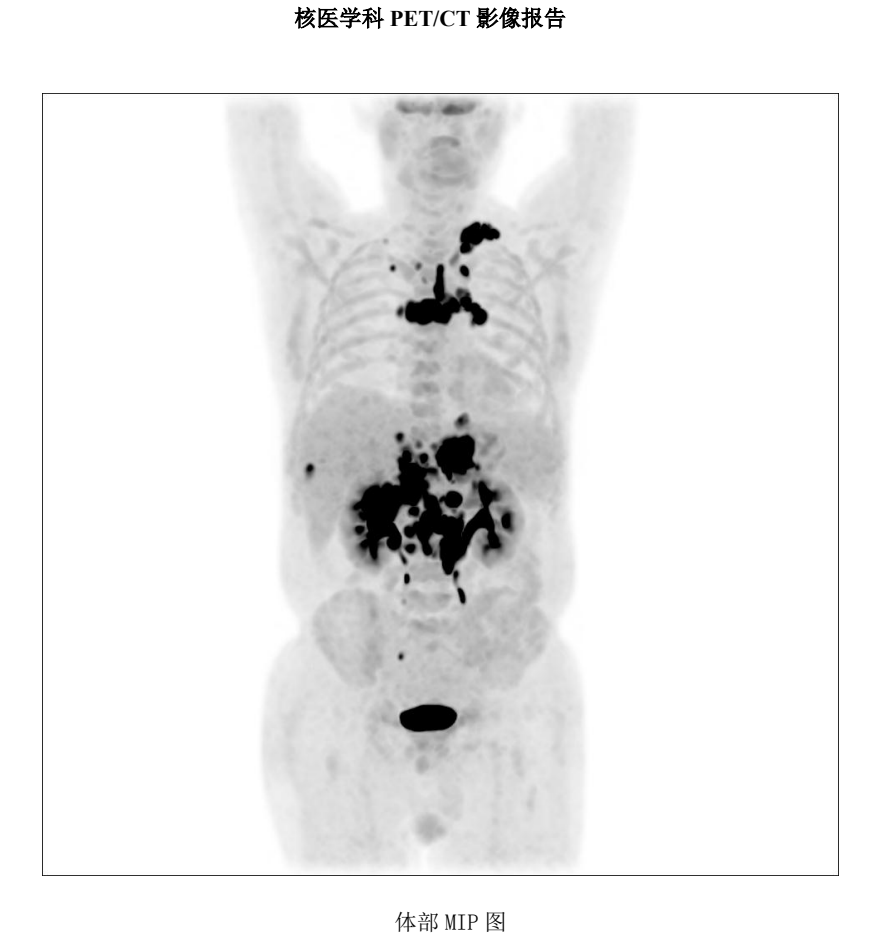
三靶点 CAR-T 出击
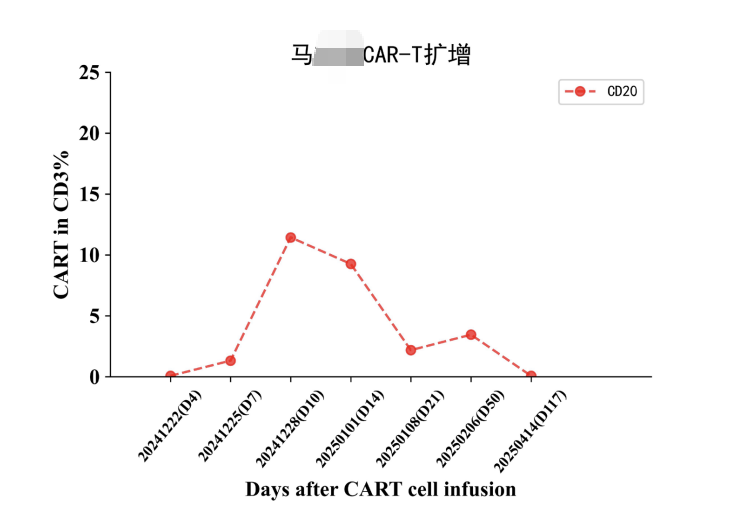
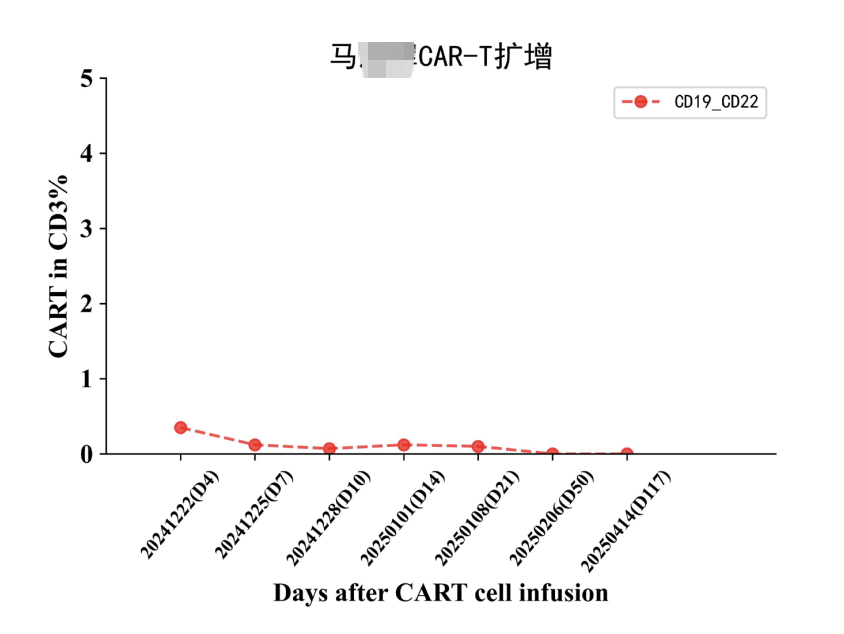
再次对病灶进行活检,结果显示CD19(-)、CD20(-)、CD22(弱 +) 。面对这一结果,治疗似乎陷入了僵局,靶点几乎全部缺失,接下来该如何应对?最终,主任决定更换细胞制备公司,并采用CD19、CD20、CD22三靶点CAR-T疗法进行治疗。结果显示,CD20-CAR-T细胞扩增良好,而CD19、CD22靶点未见明显扩增。
2025 年 2 月,PET-CT 评估显示完全缓解(CR) ,Deauville 评分为 1 分(提示无肿瘤活性),全家喜极而泣!
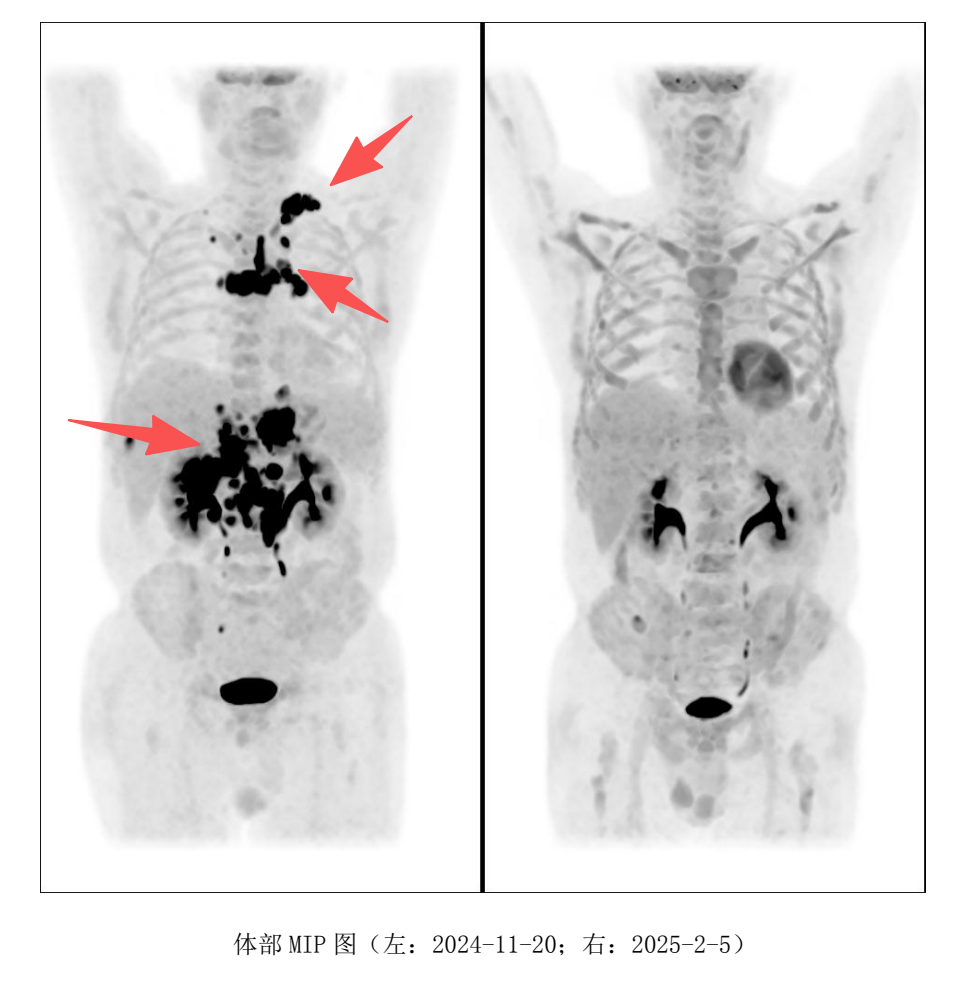
然而,我们仍不敢掉以轻心,继续采用口服西达本胺进行维持治疗。从结果看,这次的CR极有可能是来自于CD20靶点CAR-T的作用,CD19,CD22在丢失表达的肿瘤这里失去了抗原的刺激,没法识别到肿瘤了,而CD20这个靶点意外的扩增是个没想到的结果,原来细胞公司表示在先前研究中,也遇到过肿瘤细胞CD20表达丢失的情况,但是他们CAR-T成功扩增的结果,然而单独一个CD20靶点的CAR-T细胞扩增能否长期持续缓解呢?我们内心都是打鼓,不踏实的。
狡猾的肿瘤
2025 年 4 月,老马无诱因再次发热,是的,肿瘤不出意外地又回来了,PET-CT 复查显示疾病进展,怎么办?还有什么方案?
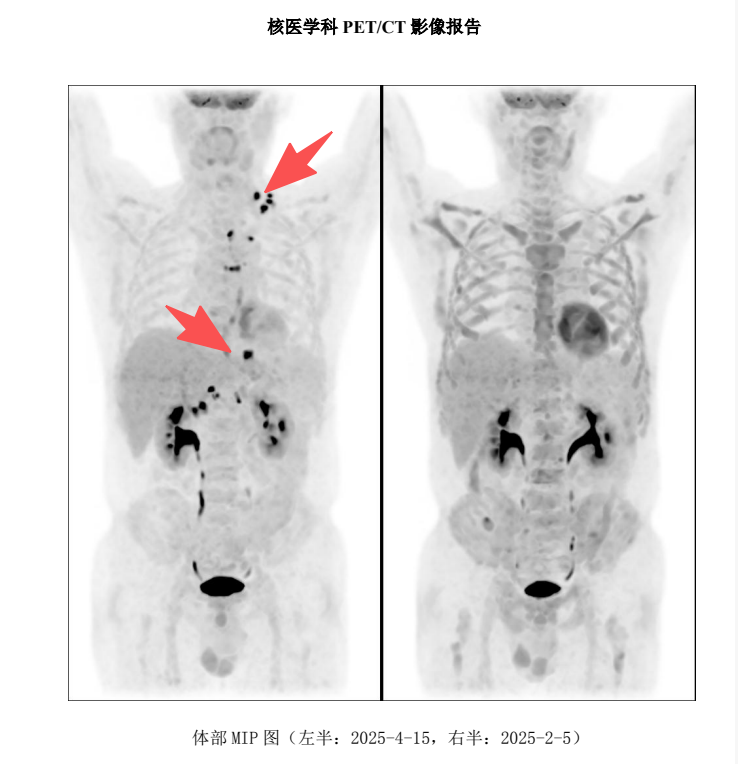
如此难治耐药的肿瘤,难道就要缴械投降了吗?
东风快递 使命必达
我与老马的女儿沟通后得知,家人不愿放弃,决心继续努力。摆在面前的治疗方案确实所剩无几,最终医生与家属商讨决定采用异基因造血干细胞移植(allo-HSCT) ,家属儿子的干细胞加脐带血干细胞!
很多病友疑惑:移植不需要完全缓解(CR)后再做吗?
对于自体造血干细胞移植(auto-HSCT)而言,需尽可能达到CR,才有可能实现长期缓解,而异基因造血干细胞移植(allo-HSCT)则不同,只需在部分缓解且肿瘤负荷整体不高的情况下,即可启动移植程序,因为供者的免疫细胞是对抗肿瘤的强大武器,而且在移植前,还需进行全身的TBI(全身放疗)和化疗,以进一步降低肿瘤负荷。
因此,即便大部分治疗方案已尝试过,仍存在进行异基因移植的机会,只是在过去,由于患者身体条件不佳、经济能力有限,以及医生对移植后排异反应和感染的顾虑等综合因素,仅有极少数患者能够选择这一治疗方案。但幸运的是,马叔叔未经历过太多化疗的折磨,身体状况尚可,这为异基因移植的顺利进行奠定了良好基础。
25年5月底进仓,6月初陆续回输了半相合的儿子干细胞以及脐带血细胞,6.25出仓,PET-CT评估,完全缓解!
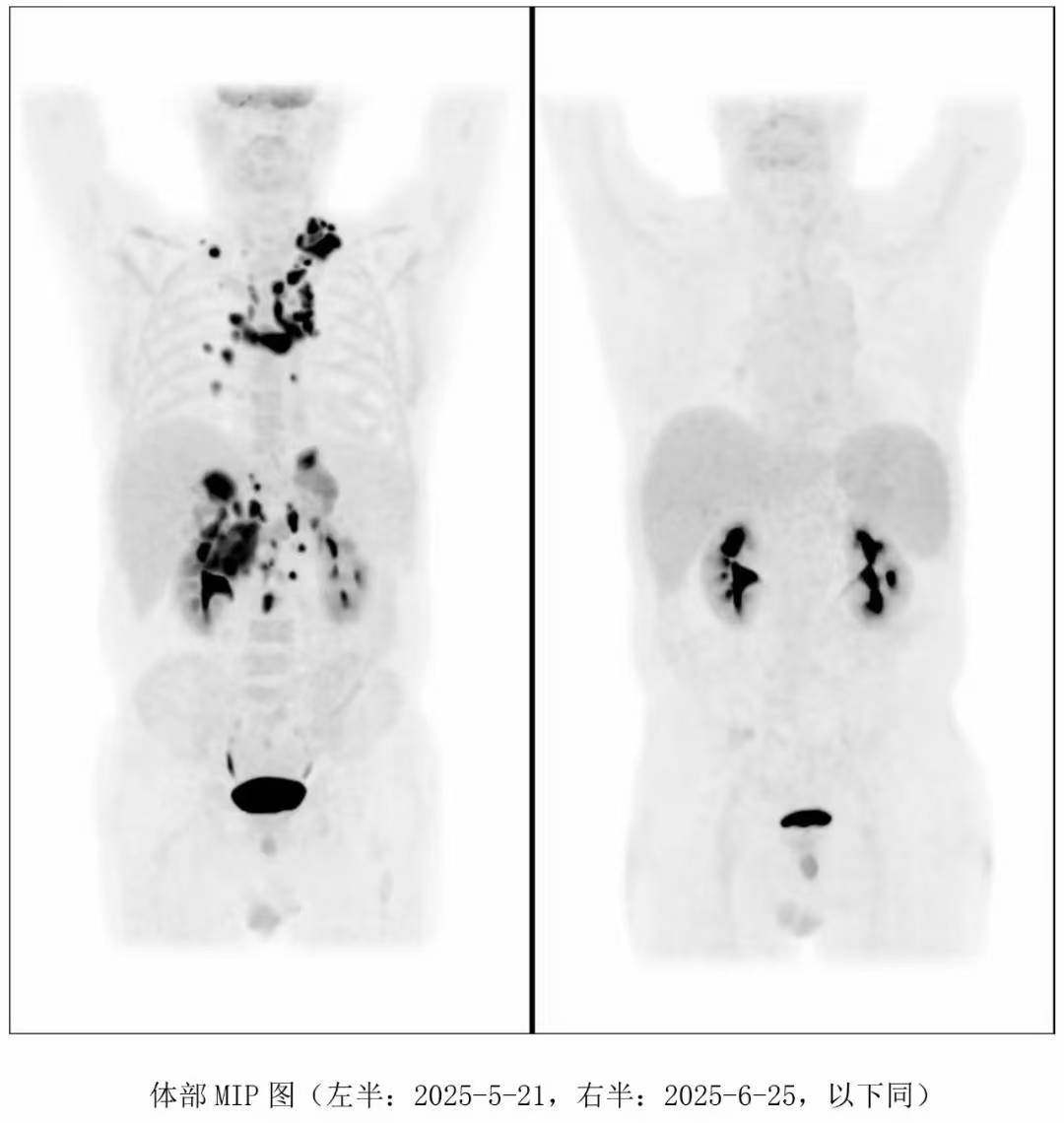
7月份,我去病房看了下其他病友,转到老马床位边的时候,因为我也是第一次见老马,没认出来他,没想到他声音洪亮地和我说:"我是老马!"
等我再次去看他的时候,他刚经历完3个月的观察期,目前老马已经出院回到家中,未出现明显排异反应,逐步恢复正常生活。
这例患者解答了许多病友的疑问:CAR-T 治疗失败后,还有什么解决方案?是不是无路可走?答案是 “当然不是!”
根据我近期看到的一篇意大利研究者的文献报道¹,回顾性分析显示,CAR-T 治疗后用双特异性抗体桥接异基因造血干细胞移植已被探索:在 35 例接受格菲妥单抗(CD20/CD3 双特异性抗体) 治疗的患者中,20 例(57%)达到 CR,5 例(14%)达到 PR,12 例(34%)对治疗无反应;中位无进展生存期(PFS)为 4 个月,中位总生存期(OS)未达到。
移植情况:13 例患者(37%)最终接受异基因造血干细胞移植(allo-HSCT),所有患者均成功植入,未发生非复发死亡(NRM);中位随访时间 18.4 个月,所有接受移植的患者均存活且维持 CR。
未移植患者预后较差:22 例未接受移植的患者,中位总生存期为 11.3 个月,13 例(59%)因疾病进展死亡。
从这份样本可见,若有机会进行异基因移植,尽量选择以巩固疗效,才有可能实现长期生存。
经历了老马这一年的起起伏伏的治疗,深刻感受到淋巴瘤的复杂性,多次进展不仅在情绪上,在身体上都在透支家庭的信心,也挑战医生的决策,以及我们现有的医疗资源和技术,希望老马的经历能让CAR-T后失败的病友看到希望。不要怕,太阳下山,还有月光~
回到故事开头的那位家属求助,根据老马的经验总结以及文献报道,他的爱人接受了1次双抗的桥接减瘤后目前也已经进仓接受异基因造血干细胞移植,这次是父(62岁)供子,等待胜利出仓。
病 例 启 示
1.复发/难治的弥漫大B应做活检确认,完善免疫组化标记表达率情况,为后续细胞治疗,双抗应用等提供指导。
2.免疫组化中CD20标记即使阴性,CD20-CAR-T细胞治疗也可能有效。
3.CAR-T治疗失败后,需要积极考虑异基因移植。
参考文献
1. Barone A, De Philippis C, Stella F, et al. Br J Haematol. 2025 Sep;207(3):956-964.
|  /1
/1 