|
关于套细胞淋巴瘤
“CAR-T 治疗后复发就没救了?”“复发后生存期只剩几个月?”“化疗、靶向药都试过了,还有别的选择吗?”
太多套细胞淋巴瘤患者在 CAR-T 疗法后遭遇疾病进展(POD),陷入这样的绝望疑问。明明 CAR-T 曾带来过缓解的希望,可一旦病情反复,不少人就被 “预后极差” 的说法困住,甚至放弃进一步治疗。
最新的《Blood Advances》期刊发布了一项题为 “Treatment and outcomes of progression of disease post–CAR T-cell therapy in mantle cell lymphoma: a multicenter analysis”《套细胞淋巴瘤 CAR-T 细胞治疗后疾病进展的治疗与结局:多中心分析》的重磅研究,该研究覆盖 15 个国际中心、384 例患者,其核心发现打破了 “CAR-T 后复发即绝境”的认知——精准评估以及合理治疗,仍能为部分患者争取生存机会。

1 CAR-T 后复发真的没辙?这些数据戳破现实
套细胞淋巴瘤(MCL)本身就是血液肿瘤中 “难治且易复发” 的类型,尤其是复发 / 难治(R/R)患者,传统治疗效果有限。而 CD19 导向的 CAR-T 疗法(如利基奥仑赛、阿基仑赛)的出现,曾给这类患者带来突破性希望——临床数据显示,CAR-T 治疗的总缓解率(ORR)能达到 83%-91%,中位无进展生存期(PFS)最长可达 25.8 个月。
CAR-T 并非“一劳永逸”的治愈方案,研究发现,35%的患者在CAR-T输注后会出现疾病进展(POD),中位进展时间仅 6 个月,且一旦进展,预后确实不容乐观:中位无进展生存期(PFS)仅 2.5 个月,中位总生存期(OS)仅 5.4 个月,1 年生存率也只有 36%。
值得关注的是这些复发患者往往带着“高危标签”:51% 存在 TP53 突变(肿瘤耐药的关键因素),77% 的肿瘤细胞增殖指数 Ki67≥50%(提示肿瘤进展迅猛),37% 表现为侵袭性更强的母细胞/多形性形态,部分患者还合并中枢神经系统(CNS)受累——这些特征都让后续治疗难上加难。
2 高危信号早知道 如何应对疾病进展?
尽管 POD 后的治疗挑战重重,但研究通过分析 105 例接受后续系统治疗的患者数据,发现了一批潜力疗法,更明确了 “谁能获益、选哪种方案” 的核心逻辑。
作为近年血液肿瘤领域的 “明星药物”,双特异性抗体在CAR-T后复发的患者中表现最为突出:13 例接受治疗的患者,总缓解率(ORR)高达 67%,且全部为完全缓解(CR),中位缓解持续时间(DOR)达 10.5 个月,中位 PFS 也有 8.1 个月。
简单来说,这类药物能同时绑定肿瘤细胞上的 CD20 抗原和免疫 T 细胞上的 CD3 分子,直接 “搭桥” 让免疫细胞精准杀伤肿瘤,即使 CAR-T 治疗后 T 细胞功能有一定损耗,仍能发挥作用,对于 CAR-T 后复发、身体不耐受强化疗的患者,堪称优选方案。
而对于携带 TP53 突变、Ki67 高表达等高危特征的患者,单一药物往往难以奏效,但小分子抑制剂联合方案(如伊布替尼 + 维奈克拉、利妥昔单抗 + 来那度胺 + 硼替佐米等)展现出强大潜力:8 例接受治疗的患者中,5 例实现缓解,ORR 达 63%,其中 4 例达到完全缓解。
这类方案的核心是协同作战—— 比如 BTK 抑制剂抑制肿瘤信号通路,BCL2 抑制剂诱导肿瘤细胞凋亡,再配合抗 CD20 单抗增强免疫杀伤,能有效突破肿瘤耐药壁垒,尤其适合 CAR-T 后快速进展的患者。
此外,对于年轻、身体状态较好(能耐受移植)且治疗后获得缓解的患者,异基因造血干细胞移植是潜在的治愈选项,研究中 8 例接受移植的患者,6 例至今无病生存(中位随访 9 个月),仅 1 例因移植物抗宿主病死亡,1 例复发后仍在接受后续治疗,这提示如果患者在 CAR-T 复发后能通过前期治疗控制病情,且符合移植条件,应尽早考虑 allo-HCT—— 即使是高危 MCL,移植也能带来长期生存的可能。
同时,研究也明确了哪些患者复发后预后更差,需要重点关注:CAR-T 输注后 3 个月内就复发(OS 显著缩短)、对 CAR-T 治疗本身无响应(完全缓解率低)、存在 17p 缺失或 TP53 突变(肿瘤恶性程度高)、年龄≥65 岁、体力状态评分(ECOG)≥2(身体耐受能力弱),这类患者更需要“个体化 + 多学科”的精准方案,甚至优先考虑临床试验,避免延误最佳治疗时机。
图解分析
图1A中,曲线在复发后前 2.5 个月下降最为陡峭,对应中位无进展生存期仅 2.5 个月 —— 意味着一半患者在复发后 2.5 个月内会出现病情再次进展或死亡;后续曲线逐渐平缓,但仍维持在较低比例,说明仅少数患者能实现长期无进展生存。
图1B中,中位总生存期为 5.4 个月,曲线在复发后 6 个月内快速下滑,1 年时存活比例仅 36%,之后下降速度放缓,提示度过初期高风险期后,部分患者可获得较长生存时间;
两张曲线共同印证了 “CAR-T 后复发患者整体预后较差,但存在生存分层” 的特点,也凸显了 “复发后尽早启动有效治疗” 的紧迫性 —— 初期 6 个月是挽救生存的关键窗口。
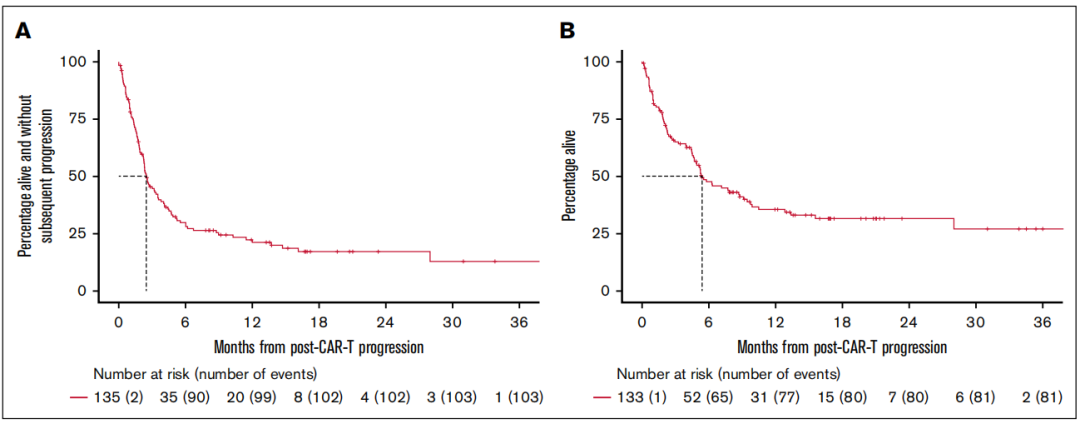
图 1:CAR-T 后复发患者的整体生存曲线(PFS 与 OS)
图2中三条曲线分别对应三组患者 ——“<3 个月复发”“3-6 个月复发”“>6 个月复发”。
对于 “<3 个月复发” 的患者,需直接采用最强效的治疗方案(如双特异性抗体联合靶向治疗)或优先纳入临床试验;而 “>6 个月复发” 的患者,可根据身体状态选择相对温和的精准治疗,在疗效与安全性间达到平衡。
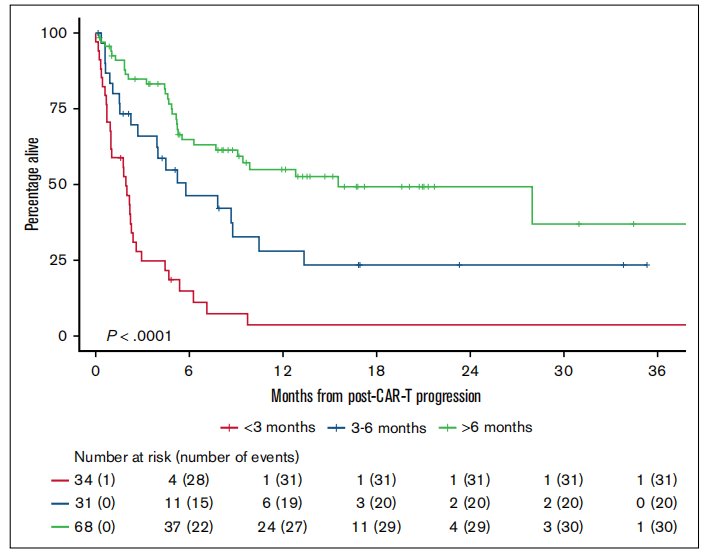
图 2:按 “CAR-T 输注到复发时间”分组的生存差异曲线
3 CAR-T 后复发的实操方案
针对 CAR-T 后疾病进展的患者,研究给出了清晰的临床管理路径,核心是 “尽早评估、精准选药、多学科协作”。
一旦确诊 CAR-T 后疾病进展(POD),应在 1 周内转诊至 CAR-T 专科中心或淋巴瘤诊疗中心,最好在启动下一线治疗前完成评估 —— 因为此时患者的 T 细胞功能尚未被后续化疗过度耗竭,更有利于后续治疗(如双特异性抗体、联合靶向治疗)发挥作用。
转诊后需完成全面评估,核心是 “明确患者能否耐受治疗、哪种方案最有效”:血液科医生评估肿瘤负荷(如肿瘤大小)、病理类型(是否为母细胞 / 多形性)、基因特征(TP53、17p 缺失);心内科 / 呼吸科优化基础病(如高血压、肺部疾病),降低治疗不良反应风险;感染科筛查潜在感染(如乙肝、真菌),提前预防治疗;移植科对年轻患者评估异基因造血干细胞移植可行性。
治疗方案选择则遵循 “分层原则”:身体状态好、无严重合并症的患者,优先考虑双特异性抗体或小分子抑制剂联合方案,争取深度缓解后桥接异基因移植;身体状态一般、合并症多的患者,首选双特异性抗体(安全性更优),或低强度联合靶向治疗(如维奈克拉 + 利妥昔单抗);肿瘤进展极快、高危特征多的患者,建议加入针对性临床试验(如新型 CAR-T、双特异性抗体联合免疫检查点抑制剂);无法耐受系统治疗的患者,可考虑局部治疗(如放疗、手术切除孤立病灶),或最佳支持治疗。
治疗后的监测也需分阶段进行:输注后 2 周内住院密切监测(如细胞因子释放综合征 CRS、神经毒性 ICANS),这是不良反应高发期;2 周至 1 年转至社区医院随访,重点监测迟发性血细胞减少、感染(需长期抗感染预防)、疾病复发;1 年后每年复查 PET-CT 和免疫功能,评估长期缓解情况,警惕第二原发肿瘤(中位发生时间约 10 个月)
4 核心建议与临床意义
重视每例 POD 患者的个体化评估,不要轻易放弃治疗,同时避免将自体干细胞移植(ASCT)的严格标准套用在后续治疗上(如年龄、器官功能),更多关注 “患者能否耐受、是否有多学科支持”,确诊 POD 后立即启动转诊,为患者预留足够的治疗准备时间(如双特异性抗体治疗前的评估、移植配型)。
对患者及家属来说,不要被 “中位生存期 5.4 个月” 的数字吓倒 —— 这是群体数据,部分患者通过精准治疗能获得长期生存,切勿主动放弃,要积极配合多学科评估,主动告知医生既往病史(如高血压、精神疾病),以便医生制定安全方案,同时关注临床试验机会,尤其是新型双特异性抗体、联合靶向治疗的研究,可能带来额外获益。
5 局限性与未来方向
尽管这项研究为 CAR-T 后复发患者的治疗提供了重要参考,但它也存在一些局限性,需要客观看待。首先,不同研究中心的疗效评估标准并不统一,部分患者的治疗响应数据存在缺失,可能会影响结果的准确性。其次,研究中多数患者使用的是 brexu-cel(87%),只有 13% 使用 liso-cel,没法判断不同 CAR-T 产品对后续复发风险和治疗效果的影响。
再者,部分治疗方案的患者样本量太少,比如异基因造血干细胞移植仅 8 例,小分子抑制剂联合疗法也只有 9 例,无法对不同治疗方案的疗效做正式的横向比较,结论的说服力有待进一步验证。而且这是一项回顾性研究,不是提前设计好的前瞻性试验,可能存在选择偏倚 —— 比如纳入的患者可能更适合接受某种治疗,导致研究结果不能完全推广到所有 CAR-T 后复发的患者。
另外,并非所有患者在疾病进展(POD)时都做了病理活检,这在一定程度上限制了对复发时肿瘤特征的全面理解,也没法明确这些特征如何影响后续治疗效果和生存结局。
总结
R/R MCL 患者 CAR-T 治疗后 POD 的临床结局极差,需优先将该人群纳入前瞻性多中心临床试验,重点探索 BsAb、小分子抑制剂联合等新型治疗策略。对于经后续治疗达缓解且符合条件(年龄 < 65 岁、体能状态良好、存在合适供者)的患者,应尽早评估 allo-HCT 的可行性。
未来需进一步明确 CAR-T 治疗失败的生物学机制,开发针对性治疗靶点,并探索维持治疗、早期 CAR-T 干预等策略以延缓 POD 发生,最终改善患者生存预后。
资料来源: Epstein-Peterson ZD, et al. Blood Adv. 2025 Nov 11;9(21):5654-5662.
|  /1
/1 