- 主题
- 217
- 您的身份
- 病友
- 病理报告
- 滤泡性淋巴瘤1-2级
- 目前状态
- 治疗中
参加活动:0 次 组织活动:0 次
您的身份病友
病理报告滤泡性淋巴瘤1-2级
目前状态治疗中
最后登录2026-2-27
|
重磅新型CD3/CD20双抗Epkinly(epcoritamab)获美FDA加速批准!
2023年5月19日,艾伯维(AbbVie)和Genmab公司宣布,美国FDA已加速批准CD3/CD20双特异性抗体疗法Epkinly(epcoritamab)上市,用于治疗复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL),包括由惰性淋巴瘤发展而成的DLBCL以及高级别B细胞淋巴瘤(HGBL),这些患者已经接受过两种或多种系统治疗。值得一提的是,这是首款获FDA批准治疗DLBCL患者的双特异性抗体疗法。
Epkinly是一种皮下给药,基于Genmab公司专有的DuoBody技术构建的IgG1亚型双特异性抗体。Genmab的DuoBody-CD3技术旨在选择性地引导细胞毒性T细胞向靶细胞类型产生免疫反应。它同时结合T细胞上的CD3和B细胞上的CD20,并诱导T细胞介导的CD20阳性细胞的杀伤。
商品名:Epkinly
通用名:epcoritamab
靶点:CD3/CD20
厂家:艾伯维(AbbVie)、Genmab公司
美国首次获批:2023年5月
中国首次获批:尚未获批
获批适应症:弥漫性大B细胞淋巴瘤
规格:4mg/0.8mL/瓶、48mg/0.8mL/瓶
推荐剂量:皮下注射;第1周期:第1天0.16mg,第8天0.8mg,第15天和第22天48mg;第2-3周期:第1、8、15和22天48mg;第4-9周期:第1天和第15天48mg;第10周期及以后:第1天48mg。
储存条件:2℃至8℃冷藏
临床数据
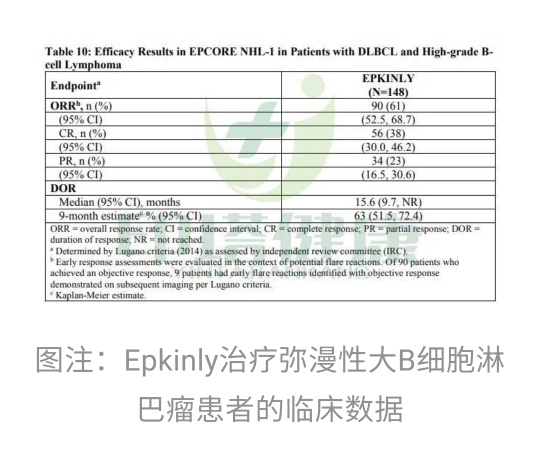
此次的批准是基于I/II期EPCORE NHL-1试验的研究结果。在这项试验中,旨在评估Epkinly治疗弥漫性大B细胞淋巴瘤患者的疗效和安全性。试验的终点主要是客观缓解率(ORR)和持续缓解时间(DOR)。
在该试验中,疗效人群包括148例弥漫性大B细胞淋巴瘤患者。入组患者的人群特征包括:中位年龄为65岁,62%的患者为男性,97%的患者ECOG评分为0或1,3%的患者ECOG评分为2。既往治疗的中位数为3,其中30%接受2次既往治疗,30%接受3次既往治疗,40%接受4次或更多既往治疗。其中39%的患者曾接受过嵌合抗原受体(CAR)T细胞疗法,29%的患者对CAR-T细胞疗法产生了耐药性。
试验结果显示,在所有接受Epkinly治疗的患者中,客观缓解率(ORR)为61%,完全缓解率(CR)为38%,部分缓解率(PR)为23%。中位缓解持续时间(DOR)为15.6个月;9个月的DOR率为63%。
|
|
 /1
/1 